一、2019年医疗器械不良事件监测工作进展
2019年,医疗器械监测体系逐步完善,北京市医疗器械不良事件监测网络已覆盖到北京市全部第三类医疗器械生产企业、一级以上医疗机构及全部第二、三类医疗器械生产企业;国家药品不良反应监测系统北京市有效注册用户达13820个,比2018年增加902个,其中,器械经营企业11610个,占用户总数的84.01%,器械持有人1154个(含进口产品代理企业),占用户总数的8.35%;医疗机构注册用户1056个,占用户总数的7.64%。
探索开展重点监测和再评价等上市后器械安全性研究工作,开展医用超声耦合剂再评价,指导存在风险的生产企业进行产品改进风险点;顺利完成国家“十三五”6个品种的安全性重点监测工作。
二、北京市可疑医疗器械报告情况
2019年,北京市收到由北京市监测单位上报的可疑医疗器械不良事件报告8163份,达到379份/百万人口,反映我市医疗器械报告意识良好,报告收集能力稳步提升;我市二级以上医疗机构《可疑医疗器械不良事件报告表》连续五年消灭零报告,生产企业主动报告意识提升,各区报告覆盖率达到100%。
2019年,北京市共收到18870份有效医疗器械不良事件报告,从医疗器械管理类别来看,Ⅰ类器械产品相关报告1083份,占报告总数的5.74%;Ⅱ类器械产品相关报告10194份,占报告总数的54.02%;Ⅲ类器械产品相关报告7593份,占报告总数的40.24%。(见附图)。Ⅱ类、Ⅲ类医疗器械的报告构成报告主体,与医疗器械风险程度高低相吻合。
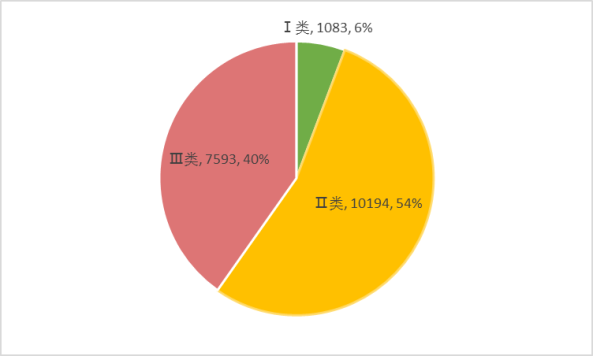
附图:管理类别报告百分比统计
小贴士
2. 医疗器械不良事件监测定义:是指对医疗器械不良事件的收集、报告、调查、分析、评价和控制的过程。
3.医疗器械重点监测定义:是指为研究某一品种或者产品上市后风险情况、特征、严重程度、发生率等,主动开展的阶段性监测活动。
4.医疗器械再评价定义:是指对已注册或者备案、上市销售的医疗器械的安全性、有效性进行重新评价,并采取相应措施的过程。
5. 北京市可疑医疗器械不良事件监测报告全部上报国家药品监督管理局,作为全国医疗器械不良事件监测数据,为全面评价器械风险,采取风险控制措施提供参考。
6.不同医疗器械的不良事件报告数量受使用数量、报告意识、风险程度等诸多因素影响。因此,各品种可疑医疗器械不良事件报告数的多少,不直接代表该医疗器械的不良事件发生率的高低,或实际风险程度的高低。
来源:北京市药品监督总局