2022年以来,国家药监局坚持以习近平新时代中国特色社会主义思想为指导,深刻理解贯彻“坚持人民至上”的根本价值取向,严格落实“最严谨的标准”要求,以推动高质量发展为主题,统筹推进医疗器械标准各项工作。
一、 强化标准组织体系建设
(一)积极推进监管急需和创新领域成立新标准化组织。2022年首个与其他行业主管部门联合申请的全国医疗装备产业与应用标准化工作组正式获批成立,中医器械标准化技术归口单位正式获批成立。全国医用防护器械标准化工作组和医疗器械可靠性与维修性、口腔数字化医疗器械标准化技术归口单位获批准筹建,正按程序积极组建。进一步填补了医疗器械标准化组织空白领域,优化了标准组织体系结构和布局。
截至2022年12月31日,医疗器械标准技术组织已达37个(见图1),包括13个总标委会(TC)、13个分标委会(SC)、1个标准工作组和10个技术归口单位。
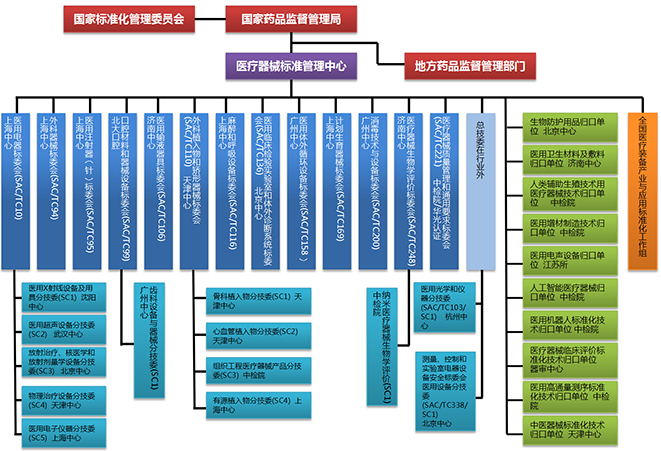
图1. 医疗器械标准组织架构图
(二)强化技术归口单位管理。为进一步规范医疗器械标准化技术归口单位的组建、换届、调整和监督管理,科学开展医疗器械标准化工作,组织制定并印发《医疗器械标准化技术归口单位管理细则(试行)》,强化技术归口单位管理。
(三)健全标委会考核机制。在历年考核评估工作的基础上,总结经验组织修改完善《医疗器械标准化技术委员会考核评估细则》,部署组织开展2022年度医疗器械标准化技术委员会考核评估工作,进一步优化完善医疗器械标委会和归口单位考核评价指标体系,健全考核激励机制。
二、 优化评估强制性标准
根据《医疗器械强制性标准优化工作方案》要求,组织完成396项医疗器械强制性标准和62个在研强制性标准项目优化评估。优化评估结果为:458项医疗器械强制性标准和在研项目中,建议转推荐125项、废止23项、修订136项、继续有效174项(见图2)。

图2.医疗器械强制性标准优化评估统计图
积极推动医疗器械强制性标准优化评估结果落实,2022年9月,《国家药监局关于废止YY 1075-2007〈硬性宫腔内窥镜〉等20项医疗器械强制性行业标准的公告》(2022年第75号)《国家药监局关于92项医疗器械强制性行业标准和在研项目转化为推荐性行业标准和在研项目的公告》(2022年第76号)正式印发,同时积极上报强制性国家标准和在研项目优化评估建议,并指导修订项目按计划完成修订工作,实现医疗器械强制性标准体系全面优化提质。
三、 优化医疗器械标准技术体系
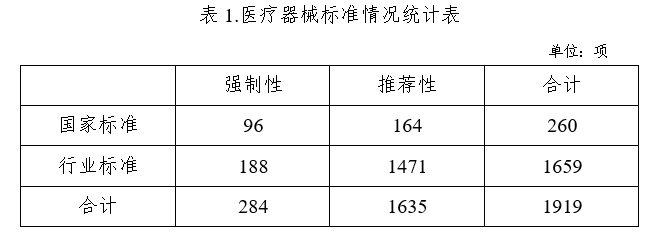
2022年下达医疗器械国家标准立项计划42项,医疗器械行业标准制修订计划项目117项(其中强制性项目23项,推荐性项目94项);发布医疗器械国家标准40项,医疗器械行业标准114项,医疗器械行业标准修改单4项。截至2022年12月31日,医疗器械标准共1919项(见表1),医疗器械标准技术体系持续优化。
(一) 加大新兴产业医疗器械标准研制
2022年重点支持64项人工智能医疗器械、新型生物医用材料、伴随诊断、新型分子诊断技术等高端、创新领域医疗器械行业标准研制。对胶原蛋白等我国优势创新生物医用材料领域标准重点支持,采取快速程序,组织《重组人源化胶原蛋白》监管急需标准紧急立项、快速制定、优先审核,并同步组织推进国际标准预研和新项目申请,抢占国际标准先机。
(二) 标准数量持续提升
截至2022年12月31日,医疗器械标准共1919项,近年来,医疗器械标准数量稳步提升(见图3)。
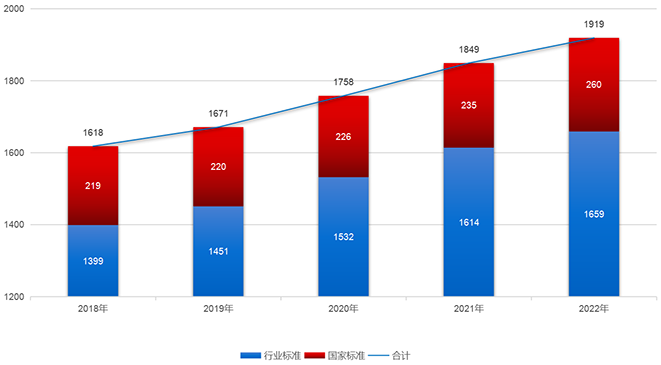
图3. 2018年—2022年医疗器械标准数量统计图
(三) 体系结构更加优化
截至2022年12月31日,按标准规范对象统计,现行有效的医疗器械标准中基础标准326项,占比17%;管理标准49项,占比3%;方法标准461项,占比24%;产品标准1083项,占比56%,基础标准的数量逐年增高(见图4)。
2022年发布的154项标准中,基础标准42项,占比27%;管理标准6项,占比4%;方法标准30项,占比20%;产品标准76项,占比49%(见图5),医疗器械标准体系结构进一步优化。
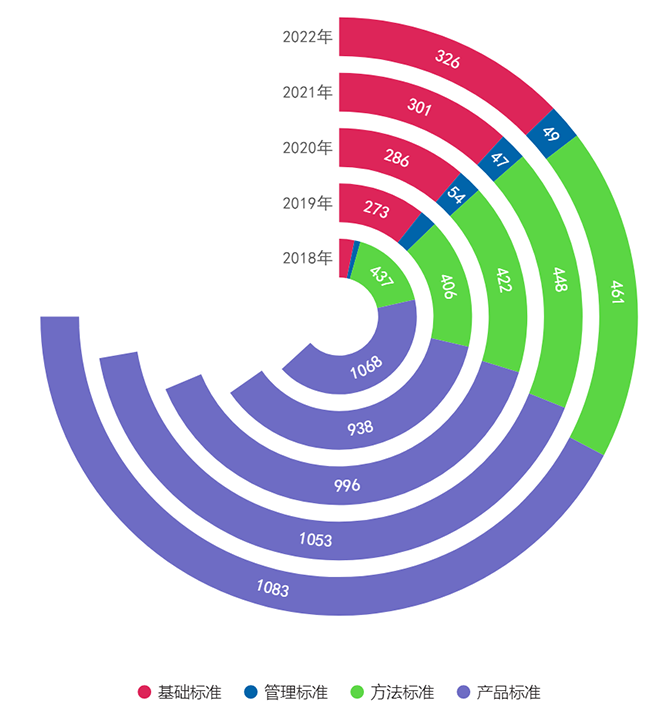
图4. 2018年—2022年发布医疗器械标准类别情况统计图
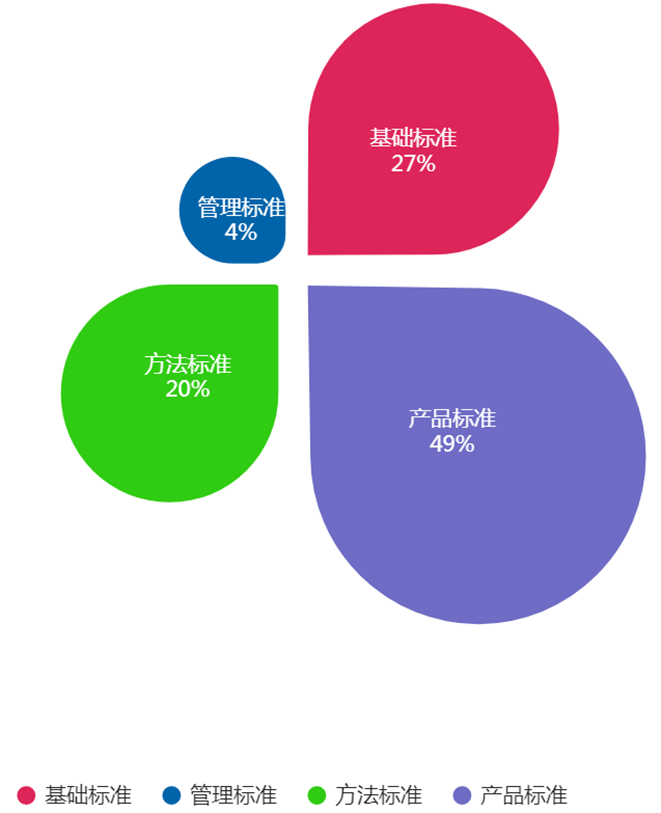
图5. 2022年发布医疗器械标准类别情况统计图
(四) 覆盖领域更加全面
截至2022年12月31日,按标准规范对象统计,现行有效的医疗器械标准按照《中国标准文献分类法》,主要归类在医疗器械综合(C30)至医用卫生用品(C48)之间,占比前5位的分别是:医用化验设备(C44)14%,矫形外科、骨科器械(C35)11%,一般与显微外科器械(C31)11%,医疗器械综合(C30)10%,口腔科器械、设备与材料(C33)9%(见图6)。医疗器械标准全面覆盖了医用电气设备、手术器械、外科植入物等医疗器械各技术领域。
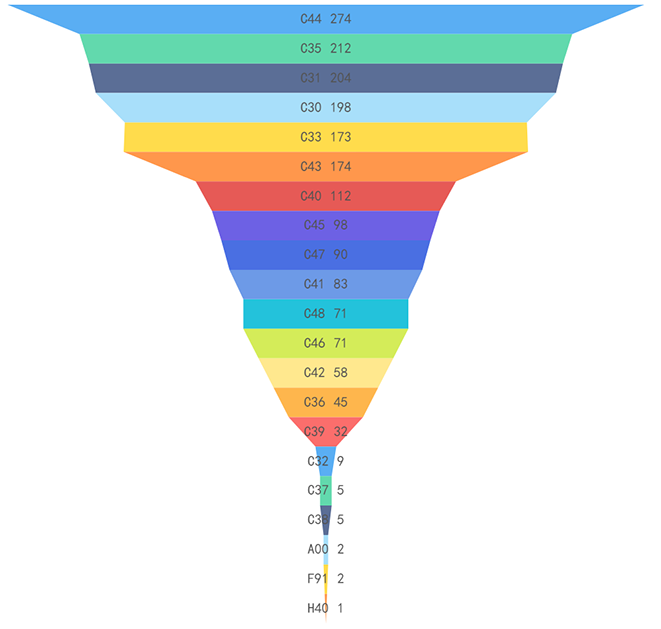
图6. 医疗器械标准各领域覆盖情况统计图(文献分类法)
2022年发布的154项标准中,发布数量排名前3的领域分别是医疗器械综合(C30)、口腔科器械、设备与材料(C33)、矫形外科、骨科器械(C35),各领域发布标准数量见图7。
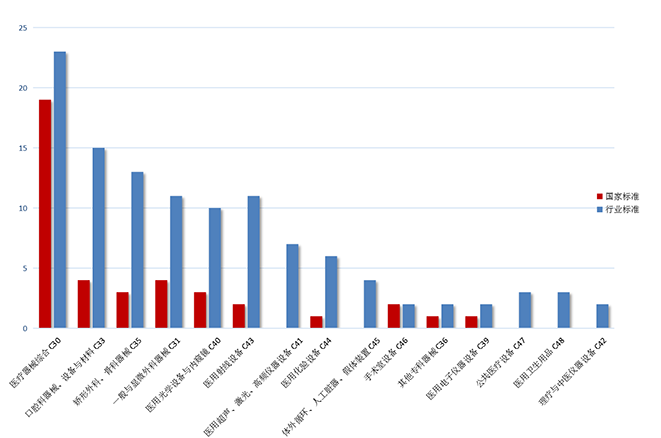
图7. 2022年发布医疗器械标准各领域分布情况统计图
四、 规范管理完善制度机制
贯彻落实《国家药品监督管理局 国家标准化管理委员会关于进一步促进医疗器械标准化工作高质量发展的意见》,进一步做好医疗器械标准制修订管理工作,从医疗器械标准制修订各环节完善管理制度,探索机制创新。
一是探索建立鼓励企业参与标准化工作机制。按照“边开展试点、边建立制度”的原则,试点向社会公开征集6项医疗器械标准第一起草单位,组织起草《企业牵头起草医疗器械推荐性行业标准工作规范(试行)》,探索企业牵头起草推荐性行业标准的新机制,促进医疗器械标准供给更加优质、及时、多元。
二是提升标准统筹管理水平。组织开展《医疗器械强制性标准确定原则》《医疗器械国家标准和行业标准确定原则》的制定,统筹指导标准层级和标准类别的科学准确划分,做好国家标准、行业标准两个层级和强制性标准、推荐性标准两个类别标准管理工作,下好医疗器械标准“一盘棋”。
三是强化标准关键环节精细化管理。修订《医疗器械标准验证工作细则》,加强标准验证;印发《医疗器械标准意见反馈及处理机制》,持续优化医疗器械标准信息反馈和沟通渠道,进一步健全标准实施反馈机制。
五、 助力新版GB 9706系列标准实施
为配合GB 9706.1-2020《医用电气设备 第1部分:基本安全和基本性能的通用要求》的顺利实施,全力推进GB 9706系列标准制修订工作。组织制定标准实施细则,编写出版标准解读和检验规程,组织编制《GB 9706.1新旧标准对照表》《GB 9706.1-2020测试和测试设备参考清单》。组织录制59项已发布标准解读视频,在器械标管中心网站开设新版GB 9706系列标准云课堂,免费向全社会公开,140余万人次在线浏览学习;组织开展为期2周的新版GB 9706系列标准线上公益培训,来自全国31个省(自治区、直辖市)和新疆生产建设兵团的4.6万余家单位、20.6万余人次参训,实现培训内容和培训范围2个“全覆盖”,进一步统一了各方对新版GB 9706系列标准的理解,为推动新版GB 9706系列标准的顺利实施奠定了坚实的基础。
六、 强化标准实施
一是组织开展2022年医疗器械标准实施评价工作。组织印发工作通知,制定实施评估工作方案,明确评估范围和工作要求,组织各医疗器械标委会、技术归口单位选取适用标准,从标准的技术内容,包括标准适用性、关键技术要求合理性、试验检测方法的可行性、适用范围准确性,和国际标准水平的对比情况,以及标准宣贯、推广、执行、应用、问题反馈等方面开展评估,力争客观公正地反映相关标准的实施情况和效果,为进一步提升标准质量、促进标准有效实施奠定基础。
二是进一步健全医疗器械标准实施情况评估机制。在总结前期医疗器械标准实施评价试点、推广工作经验的基础上,组织制定《医疗器械标准实施评价工作细则》,形成医疗器械标准全过程的闭环管理。
三是强化标准宣贯。组织制定并在器械标管中心网站对外公布2022年医疗器械标准宣贯培训计划,组织召开医疗器械标准综合知识线上培训班,加强对各标委会、技术归口单位主任委员(组长)、副主任委员(副组长)、秘书长及秘书处相关人员的标准化法规、政策培训。组织各标委会、技术归口单位共举办27次标准宣贯培训,对174项近年来新发布的、基础通用、涉及面广的医疗器械国家、行业标准开展宣贯培训,统一对标准的理解,助力标准实施。
七、 提升国际标准化工作水平
(一)我国主导制定的3项国际标准正式发布
2022年3月8日,由全国医用输液器具标准化技术委员会(SAC/TC106)主导制定的国际标准ISO 8536-15《医用输液器 第15部分:一次性使用避光输液器》已正式发布。该国际标准制定历时4年,由德国、美国等多个国家参与,形成了全球范围内统一的避光输液器的技术指标与检测试验方法,填补了国际标准空白。
2022年4月19日,由我国牵头发起的关于新型冠状病毒核酸检测的国际标准文件ISO/TS 5798:2022《体外诊断检验系统 核酸扩增法检测新型冠状病毒(SARS-CoV-2)的要求及建议》正式发布,为国际疫情防控标准化工作贡献了中国智慧,对促进全球疫情防控工作起到了积极作用。
2022年7月,由全国外科植入物和矫形器械标准化技术委员会组织工程医疗器械产品分技术委员会(SAC/TC110/SC3)主导制定的ISO/TS 24560-1:2022《组织工程医疗产品 再生关节软骨临床 dGEMRIC 和 T2-mapping 磁共振成像评估》正式发布。
(二)积极推进国外先进标准制修订
2022年7月1日,由人工智能医疗器械标准化技术归口单位主导立项的电气和电子工程师学会(IEEE)标准项目IEEE P2801《医学人工智能数据集质量管理》国外先进标准正式发布实施。该标准在起草阶段就获得了国际社会的广泛关注,被多个国家(地区)的人工智能政策文件引用。2022年9月21日,人工智能医疗器械标准化技术归口单位牵头申报的标准项目IEEE P3191《机器学习医疗器械临床性能监测推荐标准》正式获批立项,为全球人工智能医疗器械产业的健康发展贡献中国力量。
(三)积极参与国际标准化活动
组织参加国际标准化组织的标准制修订工作会议共50次,代表我国参与对口国际标准化组织的各类国际标准投票176次,新增国际标准化组织注册专家10人,积极参与国际标准化活动。
(四)持续提升与国际标准一致性程度
建立与国际标准快速联动的标准更新机制,全面梳理现有医疗器械国际标准转化情况,对“应转未转”的国际标准明确转化时间进度。2022年共提出医疗器械国际标准转化申请117项,是2020年的2倍,持续提升与国际标准一致性程度。
八、 提升标准服务水平
为发挥标准的技术支撑作用,2022年组织编制并公开《医疗器械标准目录汇编(2022版)》及《中国医疗器械标准目录及适用范围》,对现行有效的医疗器械标准的适用范围以及标准层级、效力、名称、归口单位等信息,按照医疗器械技术领域梳理公开。
及时对外公开标准文本和标准制修订全过程信息。2022年,在器械标管中心网站对外公开医疗器械标准立项信息279项,标准征求意见稿及编制说明175项,标准宣贯、委员征集等相关信息57项,现行237项医疗器械强制性行业标准文本和1000项非采标推荐性行业标准文本已全部公开。
来源:国家药品监督管理局